Lijst met elementen
»
actinium
»
argon
»
astatine
»
barium
»
bismut
»
bohrium
»
Borium
»
broom
»
cadmium
»
calcium
»
cerium
»
cesium
»
chloor
»
chromium
»
curium
»
dubnium
»
erbium
»
europium
»
fermium
»
fluorine
»
fosfor
»
francium
»
gallium
»
goud
»
hafnium
»
hassium
»
helium
»
holmium
»
ijzer
»
indium
»
iridium
»
jodium
»
kalium
»
kobalt
»
koolstof
»
koperen
»
krypton
»
lantaan
»
lithium
»
Lood
»
lutecium
»
mangaan
»
natrium
»
neon
»
Nihonium
»
nikkel
»
niobium
»
nobelium
»
osmium
»
platina
»
polonium
»
radium
»
radon
»
rhenium
»
rhodium
»
rubidium
»
rutenium
»
samarium
»
scandium
»
selenium
»
silicium
»
stikstof
»
tallium
»
tantalum
»
Tennesse
»
terbium
»
thorium
»
thulium
»
tin
»
titanium
»
uranium
»
vanadium
»
wolfraam
»
xenon
»
yttrium
»
Zilver
»
zink
»
zuurstof
»
zwavel
Xe - xenon - GEEN EDELGASMETAAL
Xenon is een natuurlijk chemisch element, atoomnummer 54, symbool Xe en atoommassa 131.293. Het is een geurloos en kleurloos edelgas dat in zeer lage concentraties in de atmosfeer van de aarde wordt aangetroffen. Het is chemisch inert en stabiel in zijn normale toestand.
xenon heeft een molaire massa van 131,3 g/mol en een dampspanning van 16,6 kPa bij 25°C. Het is zwaarder dan lucht en bij atmosferische druk is het kookpunt -111,8°C. Het heeft een smeltpunt van -108,1°C en een relatief lage dichtheid van 4,94 g/l bij 25°C.
xenon wordt veel gebruikt vanwege zijn verkoelende en lichtgevende eigenschappen. Het wordt gebruikt om fluorescentielampen te produceren en voor medische toepassingen zoals röntgenscanners of xenonlasers. Het wordt ook gebruikt om banden op te pompen, plasmastralen te produceren en vacuümpompen te maken. xenon wordt ook gebruikt in de auto-industrie voor koplampen en om de brandstoftanks van nieuwe voertuigen te vullen. Daarnaast wordt xenon gebruikt in wetenschappelijk onderzoek om verschillende fysische en chemische effecten te bestuderen, zoals gasdiffusie en stralingsabsorptie.
xenon heeft een molaire massa van 131,3 g/mol en een dampspanning van 16,6 kPa bij 25°C. Het is zwaarder dan lucht en bij atmosferische druk is het kookpunt -111,8°C. Het heeft een smeltpunt van -108,1°C en een relatief lage dichtheid van 4,94 g/l bij 25°C.
xenon wordt veel gebruikt vanwege zijn verkoelende en lichtgevende eigenschappen. Het wordt gebruikt om fluorescentielampen te produceren en voor medische toepassingen zoals röntgenscanners of xenonlasers. Het wordt ook gebruikt om banden op te pompen, plasmastralen te produceren en vacuümpompen te maken. xenon wordt ook gebruikt in de auto-industrie voor koplampen en om de brandstoftanks van nieuwe voertuigen te vullen. Daarnaast wordt xenon gebruikt in wetenschappelijk onderzoek om verschillende fysische en chemische effecten te bestuderen, zoals gasdiffusie en stralingsabsorptie.
Synthetisch
Radioactief
Vloeistof
Gasvormig
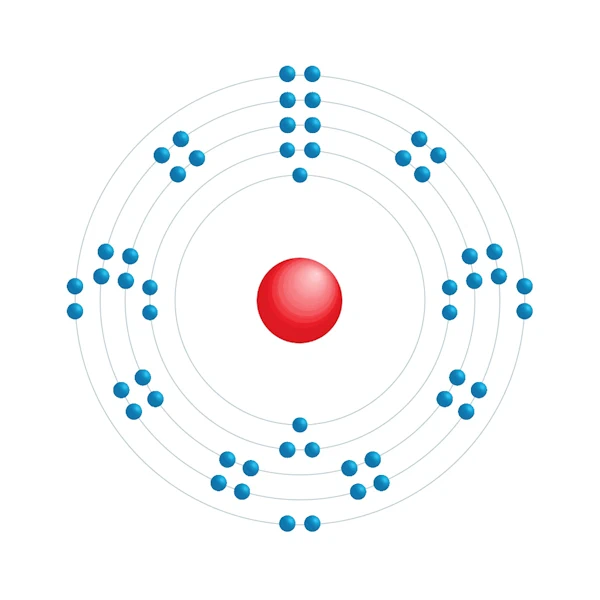
Elektronisch configuratiediagram
| Namn | xenon |
| Aantal | 54 |
| Atomair | 131.293 |
| Symbool | Xe |
| Fusie | -111.9 |
| Koken | -107 |
| Dichtheid | 0.005887 |
| Periode | 5 |
| Groep | 18 |
| Ontdekking | 1898 Ramsay and Travers |
| Overvloed | 0.001 |
| Straal | 1.2 |
| Elektronegativiteit | 0 |
| Ionisatie | 12.1298 |
| Aantal isotopen | 31 |
| Elektronische configuratie | [Kr] 4d10 5s2 5p6 |
| Oxidatie stelt | 2,4,6,8 |
| Elektron op energieniveau | 2,8,18,18,8 |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se