Lijst met elementen
»
actinium
»
argon
»
astatine
»
barium
»
bismut
»
bohrium
»
Borium
»
broom
»
cadmium
»
calcium
»
cerium
»
cesium
»
chloor
»
chromium
»
curium
»
dubnium
»
erbium
»
europium
»
fermium
»
fluorine
»
fosfor
»
francium
»
gallium
»
goud
»
hafnium
»
hassium
»
helium
»
holmium
»
ijzer
»
indium
»
iridium
»
jodium
»
kalium
»
kobalt
»
koolstof
»
koperen
»
krypton
»
lantaan
»
lithium
»
Lood
»
lutecium
»
mangaan
»
natrium
»
neon
»
Nihonium
»
nikkel
»
niobium
»
nobelium
»
osmium
»
platina
»
polonium
»
radium
»
radon
»
rhenium
»
rhodium
»
rubidium
»
rutenium
»
samarium
»
scandium
»
selenium
»
silicium
»
stikstof
»
tallium
»
tantalum
»
Tennesse
»
terbium
»
thorium
»
thulium
»
tin
»
titanium
»
uranium
»
vanadium
»
wolfraam
»
xenon
»
yttrium
»
Zilver
»
zink
»
zuurstof
»
zwavel
Ne - neon - GEEN EDELGASMETAAL
Neon is een chemisch element, ook wel edelgas genoemd, met het symbool Ne en het atoomnummer 10 op het periodiek systeem der elementen. De elektronenconfiguratie is 1s22s22p63s1. Dit betekent dat er twee elektronen in de 1s-schil zitten en zes elektronen in de 2p-schil.
neon is een kleurloos en reukloos inert gas bij kamertemperatuur en druk. Het is zeer zwak reactief en is de meest stabiele van de edelgassen. Het smeltpunt is -248,6°C en het kookpunt is -246,1°C.
neon wordt veel gebruikt in de industrie en neonlampen worden in vloeibare of gasvorm aangeboden. Het wordt gebruikt voor het maken van neonlichten en kan worden gemengd met andere gassen, zoals argon, om verschillende kleuren te produceren. Het wordt ook gebruikt als vulgas in vacuümbuizen en in industriële verlichting en straatverlichtingsproducten.
neon wordt ook gebruikt in de geneeskunde en wetenschappelijk onderzoek, aangezien de radioactieve isotoop Ne-21 wordt gebruikt als radioactieve tracer. neon heeft ook toepassingen in lasers, radioastronomie en medische beeldvorming. Het kan ook worden gebruikt om een soort koude te leveren in industriële toepassingen.
neon is een kleurloos en reukloos inert gas bij kamertemperatuur en druk. Het is zeer zwak reactief en is de meest stabiele van de edelgassen. Het smeltpunt is -248,6°C en het kookpunt is -246,1°C.
neon wordt veel gebruikt in de industrie en neonlampen worden in vloeibare of gasvorm aangeboden. Het wordt gebruikt voor het maken van neonlichten en kan worden gemengd met andere gassen, zoals argon, om verschillende kleuren te produceren. Het wordt ook gebruikt als vulgas in vacuümbuizen en in industriële verlichting en straatverlichtingsproducten.
neon wordt ook gebruikt in de geneeskunde en wetenschappelijk onderzoek, aangezien de radioactieve isotoop Ne-21 wordt gebruikt als radioactieve tracer. neon heeft ook toepassingen in lasers, radioastronomie en medische beeldvorming. Het kan ook worden gebruikt om een soort koude te leveren in industriële toepassingen.
Synthetisch
Radioactief
Vloeistof
Gasvormig
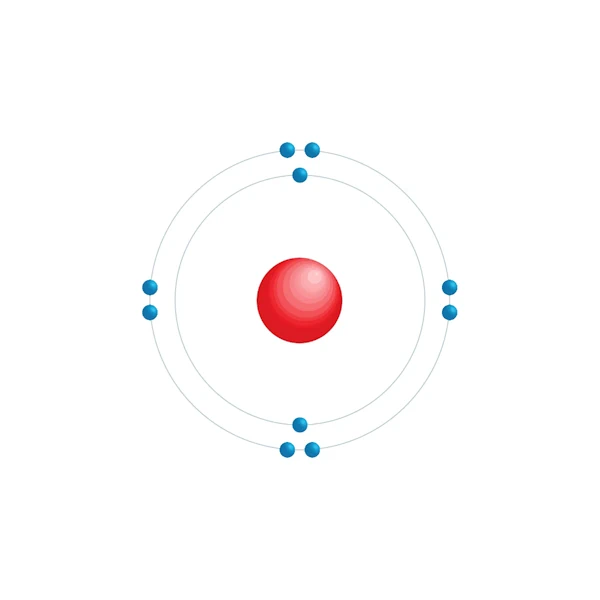
Elektronisch configuratiediagram
| Namn | neon |
| Aantal | 10 |
| Atomair | 20.1797 |
| Symbool | Ne |
| Fusie | -248.7 |
| Koken | -246.1 |
| Dichtheid | 0.0008999 |
| Periode | 2 |
| Groep | 18 |
| Ontdekking | 1898 Ramsay and Travers |
| Overvloed | 0.005 |
| Straal | 0.51 |
| Elektronegativiteit | 0 |
| Ionisatie | 21.5645 |
| Aantal isotopen | 8 |
| Elektronische configuratie | [He] 2s2 2p6 |
| Oxidatie stelt | 0 |
| Elektron op energieniveau | 2,8 |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se