Lijst met elementen
»
actinium
»
argon
»
astatine
»
barium
»
bismut
»
bohrium
»
Borium
»
broom
»
cadmium
»
calcium
»
cerium
»
cesium
»
chloor
»
chromium
»
curium
»
dubnium
»
erbium
»
europium
»
fermium
»
fluorine
»
fosfor
»
francium
»
gallium
»
goud
»
hafnium
»
hassium
»
helium
»
holmium
»
ijzer
»
indium
»
iridium
»
jodium
»
kalium
»
kobalt
»
koolstof
»
koperen
»
krypton
»
lantaan
»
lithium
»
Lood
»
lutecium
»
mangaan
»
natrium
»
neon
»
Nihonium
»
nikkel
»
niobium
»
nobelium
»
osmium
»
platina
»
polonium
»
radium
»
radon
»
rhenium
»
rhodium
»
rubidium
»
rutenium
»
samarium
»
scandium
»
selenium
»
silicium
»
stikstof
»
tallium
»
tantalum
»
Tennesse
»
terbium
»
thorium
»
thulium
»
tin
»
titanium
»
uranium
»
vanadium
»
wolfraam
»
xenon
»
yttrium
»
Zilver
»
zink
»
zuurstof
»
zwavel
mineralogie
elementen
O zuurstof
O - zuurstof - OVERIG NIET-METAAL
Zuurstof (chemisch symbool O) is een chemisch element van de chalcogeenfamilie, subgroep 16 van het periodiek systeem der elementen. Het is de belangrijkste component van de atmosfeer van de aarde en vertegenwoordigt ongeveer 20,9% van het totale volume.
zuurstof is een zeer reactieve verbinding en daarom erg belangrijk voor veel chemische reacties. Het is het derde meest voorkomende element in het universum, na waterstof en helium. Het is in staat om covalente bindingen met andere atomen te vormen en kan daarmee combineren om complexere moleculen te vormen, zoals organische verbindingen. zuurstof is een gas in zijn normale toestand, het is een kleurloos, reukloos en smaakloos gas. De chemische formule is O2 en de molaire massa is 32 g/mol.
zuurstof is een zeer reactief gas omdat het acht elektronen in zijn buitenste elektronenschil heeft. Het is een sterk oxidatiemiddel en is zeer nuttig bij verschillende chemische reacties. Het is ook zeer oplosbaar in water en is de belangrijkste bron van zuurstof die beschikbaar is voor levende wezens. zuurstof is ook brandbaar en wordt veel gebruikt in industrieën en laboratoria vanwege zijn oxiderende eigenschappen.
zuurstof is het hoofdbestanddeel van fossiele brandstoffen en is daarom erg belangrijk in het verbrandingsproces. Het wordt veel gebruikt voor verschillende industriële toepassingen, waaronder de productie van metalen, chemicaliën, meststoffen, medicijnen en farmaceutische producten. Naast industrieel gebruik wordt zuurstof gebruikt bij medische behandelingen om mensen met ernstige luchtwegaandoeningen te helpen. Het wordt ook gebruikt door veel industrieën, zoals luchtvaart, ruimtevaart en extreme sporten.
zuurstof is een zeer reactieve verbinding en daarom erg belangrijk voor veel chemische reacties. Het is het derde meest voorkomende element in het universum, na waterstof en helium. Het is in staat om covalente bindingen met andere atomen te vormen en kan daarmee combineren om complexere moleculen te vormen, zoals organische verbindingen. zuurstof is een gas in zijn normale toestand, het is een kleurloos, reukloos en smaakloos gas. De chemische formule is O2 en de molaire massa is 32 g/mol.
zuurstof is een zeer reactief gas omdat het acht elektronen in zijn buitenste elektronenschil heeft. Het is een sterk oxidatiemiddel en is zeer nuttig bij verschillende chemische reacties. Het is ook zeer oplosbaar in water en is de belangrijkste bron van zuurstof die beschikbaar is voor levende wezens. zuurstof is ook brandbaar en wordt veel gebruikt in industrieën en laboratoria vanwege zijn oxiderende eigenschappen.
zuurstof is het hoofdbestanddeel van fossiele brandstoffen en is daarom erg belangrijk in het verbrandingsproces. Het wordt veel gebruikt voor verschillende industriële toepassingen, waaronder de productie van metalen, chemicaliën, meststoffen, medicijnen en farmaceutische producten. Naast industrieel gebruik wordt zuurstof gebruikt bij medische behandelingen om mensen met ernstige luchtwegaandoeningen te helpen. Het wordt ook gebruikt door veel industrieën, zoals luchtvaart, ruimtevaart en extreme sporten.
Synthetisch
Radioactief
Vloeistof
Gasvormig
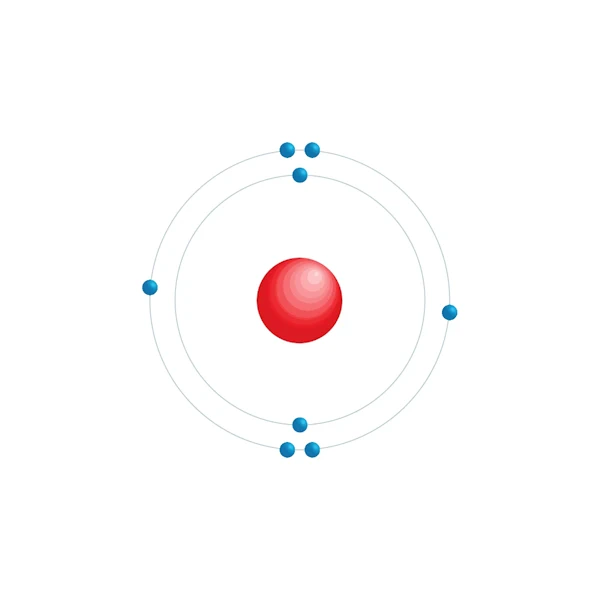
Elektronisch configuratiediagram
| Namn | zuurstof |
| Aantal | 8 |
| Atomair | 15.9992 |
| Symbool | O |
| Fusie | -218.4 |
| Koken | -182.9 |
| Dichtheid | 0.001429 |
| Periode | 2 |
| Groep | 16 |
| Ontdekking | 1774 Priestley/Scheele |
| Overvloed | 461000 |
| Straal | 0.65 |
| Elektronegativiteit | 3.44 |
| Ionisatie | 13.6181 |
| Aantal isotopen | 8 |
| Elektronische configuratie | [He] 2s2 2p4 |
| Oxidatie stelt | -2,-1,1,2 |
| Elektron op energieniveau | 2,6 |
| Mineralen | Hardheid | Dichtheid |
| Abenakiite-(Ce) | 4.00 / 4.00 | 3.21 |
| Abernathyite | 2.00 / 3.00 | 3.31 |
| Abhurite | 2.00 / 2.00 | 4.29 |
| Abswurmbachite | 6.50 / 6.50 | 4.96 |
| Abuite | ||
| Acetamide | 1.00 / 1.50 | 1.17 |
| Achalaite | ||
| Acmonidesite | ||
| Actinolite | 5.50 / 5.50 | 2.98 |
| Acuminite | 3.50 / 3.50 | 3.30 |
| Adachiite | ||
| Adamite | 3.50 / 3.50 | 4.30 |
| Adamsite-(Y) | 3.00 / 3.00 | |
| Addibischoffite | ||
| Adelite | 5.00 / 5.00 | 3.73 |
| Admontite | 2.00 / 3.00 | 1.82 |
| Adolfpateraite | 2.00 / 2.00 | 4.24 |
| Adranosite | ||
| Adranosite-(Fe) | 2.20 | |
| Adrianite | ||
| Aegirine | 6.00 / 6.50 | 3.50 |
| Aegirine-augite | 6.00 / 6.00 | 3.40 |
| Aenigmatite | 5.00 / 6.00 | 3.74 |
| Aerinite | 3.00 / 3.00 | 2.48 |
| Aerugite | 4.00 / 4.00 | 5.85 |
| Aeschynite-(Ce) | 5.00 / 6.00 | 5.19 |
| Aeschynite-(Nd) | 5.00 / 6.00 | 4.60 |
| Aeschynite-(Y) | 5.00 / 6.00 | 4.85 |
| Afghanite | 5.50 / 6.00 | 2.55 |
| Afmite | ||
| Afwillite | 3.00 / 3.00 | 2.62 |
| Agaat | 6.50 / 7.00 | 2.60 |
| Agaite | 6.99 | |
| Agakhanovite-(Y) | 6.00 / 6.00 | 2.67 |
| Agardite-(Ce) | 3.00 / 3.00 | 3.72 |
| Agardite-(La) | 3.00 / 4.00 | 3.72 |
| Agardite-(Nd) | 3.00 / 4.00 | 3.72 |
| Agardite-(Y) | 3.00 / 4.00 | 3.66 |
| Agrellite | 5.50 / 5.50 | 2.88 |
| Agricolaite | 4.00 / 4.00 | 3.53 |
| Agrinierite | 5.62 | |
| Aheylite | 5.00 / 6.00 | 2.85 |
| Ahlfeldite | 2.00 / 2.50 | 3.37 |
| Ahrensite | 4.14 | |
| Aiolosite | 3.59 | |
| Ajoite | 2.96 | |
| Akaganeite | 3.00 | |
| Akaogiite | ||
| Akatoreite | 6.00 / 6.00 | 3.48 |
| Akdalaite | 7.00 / 7.00 | 3.68 |
| Akermanite | 5.00 / 6.00 | 2.94 |
| Akhtenskite | 4.00 | |
| Akimotoite | ||
| Aklimaite | ||
| Akrochordite | 3.50 / 3.50 | 3.19 |
| Aksaite | 2.50 / 2.50 | 1.99 |
| Alamosite | 4.50 / 4.50 | 6.49 |
| Alarsite | 3.00 / 3.00 | 3.32 |
| Albertiniite | 2.46 | |
| Albite | 7.00 / 7.00 | 2.61 |
| Albrechtschraufite | 2.00 / 3.00 | 2.60 |
| Alcaparrosaite | 4.00 / 4.00 | 2.81 |
| Aldermanite | 2.00 / 2.00 | 2.00 |
| Aldridgeite | 3.00 / 3.00 | 3.33 |
| Aleksandrovite | 4.00 / 4.50 | 3.07 |
| Alexkhomyakovite | ||
| Alflarsenite | 4.00 / 4.00 | 2.61 |
| Alforsite | 5.00 / 5.00 | 4.73 |
| Alfredopetrovite | 2.50 / 2.50 | 2.50 |
| Alfredstelznerite | ||
| Aliettite | 1.00 / 2.00 | |
| Allactite | 4.50 / 4.50 | 3.00 |
| Allaniet | 5.50 / 5.50 | 3.30 |
| Allanite-(La) | 6.00 / 6.00 | 3.93 |
| Allanite-(Nd) | ||
| Allanite-(Y) | 5.50 / 5.50 | 3.30 |
| Allanpringite | 3.00 / 3.00 | 2.54 |
| Alleghanyite | 6.00 / 5.00 | 4.00 |
| Allendeite | 4.84 | |
| Allochalcoselite | 3.00 / 4.00 | 4.65 |
| Allophane | 3.00 / 3.00 | 1.90 |
| Alloriite | 5.00 / 5.00 | 2.35 |
| Alluaivite | 5.00 / 6.00 | 2.76 |
| Alluaudite | 5.00 / 5.50 | 3.45 |
| Almandine | 7.00 / 8.00 | 4.09 |
| Almarudite | 6.00 / 6.00 | 2.71 |
| Almeidaite | ||
| Alnaperbøeite-(Ce) | ||
| Alpersite | 2.50 / 2.50 | |
| Alsakharovite-Zn | 5.00 / 5.00 | 2.90 |
| Alstonite | 4.00 / 4.50 | 3.69 |
| Althausite | 3.50 / 3.50 | 2.97 |
| Althupite | 3.50 / 4.00 | 3.90 |
| Altisite | 6.00 / 6.00 | 2.64 |
| Alum-(K) | 2.00 / 2.00 | 1.76 |
| Alum-(Na) | 3.00 / 3.00 | 1.67 |
| Aluminite | 1.00 / 1.00 | 1.66 |
| Alumino-ferrobarroisite | ||
| Alumino-ferrohornblende |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se