Lijst met elementen
»
actinium
»
argon
»
astatine
»
barium
»
bismut
»
bohrium
»
Borium
»
broom
»
cadmium
»
calcium
»
cerium
»
cesium
»
chloor
»
chromium
»
curium
»
dubnium
»
erbium
»
europium
»
fermium
»
fluorine
»
fosfor
»
francium
»
gallium
»
goud
»
hafnium
»
hassium
»
helium
»
holmium
»
ijzer
»
indium
»
iridium
»
jodium
»
kalium
»
kobalt
»
koolstof
»
koperen
»
krypton
»
lantaan
»
lithium
»
Lood
»
lutecium
»
mangaan
»
natrium
»
neon
»
Nihonium
»
nikkel
»
niobium
»
nobelium
»
osmium
»
platina
»
polonium
»
radium
»
radon
»
rhenium
»
rhodium
»
rubidium
»
rutenium
»
samarium
»
scandium
»
selenium
»
silicium
»
stikstof
»
tallium
»
tantalum
»
Tennesse
»
terbium
»
thorium
»
thulium
»
tin
»
titanium
»
uranium
»
vanadium
»
wolfraam
»
xenon
»
yttrium
»
Zilver
»
zink
»
zuurstof
»
zwavel
mineralogie
elementen
Na natrium
Na - natrium - ALKALIMETAAL
Natrium is een chemisch element van de alkalimetaalfamilie dat het chemische symbool Na draagt. Het is het meest voorkomende fundamentele element in de oceanen en is een van de meest voorkomende elementen op aarde.
Puur natrium is een zacht, zilverwit metaal. Het werd ontdekt door Sir Humphrey Davy in 1807. Het is zeer reactief en reageert heel gemakkelijk met water om waterstof en natriumhydroxide te vormen.
natrium wordt veel gebruikt in de voedingsindustrie en wordt gebruikt om voedsel te zouten. Het wordt ook veel gebruikt in de chemische industrie en om zoutproducten te maken. natrium wordt ook gebruikt in de aluminiumindustrie om aluminium te produceren.
De belangrijkste kenmerken van natrium zijn de lage dichtheid en de lage thermische en elektrische geleidbaarheid. Dit betekent dat het een uitstekende thermische en elektrische isolator is. Het heeft ook een lage dampspanning en is zeer goed oplosbaar in water.
De chemische eigenschappen van natrium zijn voornamelijk te danken aan de hoge reactiviteit. natrium is zeer reactief met water, zuurstof, zwavelzuur en andere stoffen. De reactieproducten met zuurstof zijn oxiden, terwijl die met water hydroxiden en carbonaten zijn.
natrium wordt in veel industriële toepassingen gebruikt omdat het zeer reactief en overvloedig is. Enkele van de gebruikelijke toepassingen zijn het maken van zouten en het gebruik als katalysator bij bepaalde chemische reacties. Het wordt ook gebruikt in de voedingsindustrie om voedsel te bewaren en de smaak te verbeteren. Het wordt ook gebruikt voor de productie van aluminium en voor de behandeling van afvalwater.
Puur natrium is een zacht, zilverwit metaal. Het werd ontdekt door Sir Humphrey Davy in 1807. Het is zeer reactief en reageert heel gemakkelijk met water om waterstof en natriumhydroxide te vormen.
natrium wordt veel gebruikt in de voedingsindustrie en wordt gebruikt om voedsel te zouten. Het wordt ook veel gebruikt in de chemische industrie en om zoutproducten te maken. natrium wordt ook gebruikt in de aluminiumindustrie om aluminium te produceren.
De belangrijkste kenmerken van natrium zijn de lage dichtheid en de lage thermische en elektrische geleidbaarheid. Dit betekent dat het een uitstekende thermische en elektrische isolator is. Het heeft ook een lage dampspanning en is zeer goed oplosbaar in water.
De chemische eigenschappen van natrium zijn voornamelijk te danken aan de hoge reactiviteit. natrium is zeer reactief met water, zuurstof, zwavelzuur en andere stoffen. De reactieproducten met zuurstof zijn oxiden, terwijl die met water hydroxiden en carbonaten zijn.
natrium wordt in veel industriële toepassingen gebruikt omdat het zeer reactief en overvloedig is. Enkele van de gebruikelijke toepassingen zijn het maken van zouten en het gebruik als katalysator bij bepaalde chemische reacties. Het wordt ook gebruikt in de voedingsindustrie om voedsel te bewaren en de smaak te verbeteren. Het wordt ook gebruikt voor de productie van aluminium en voor de behandeling van afvalwater.
Synthetisch
Radioactief
Vloeistof
Gasvormig
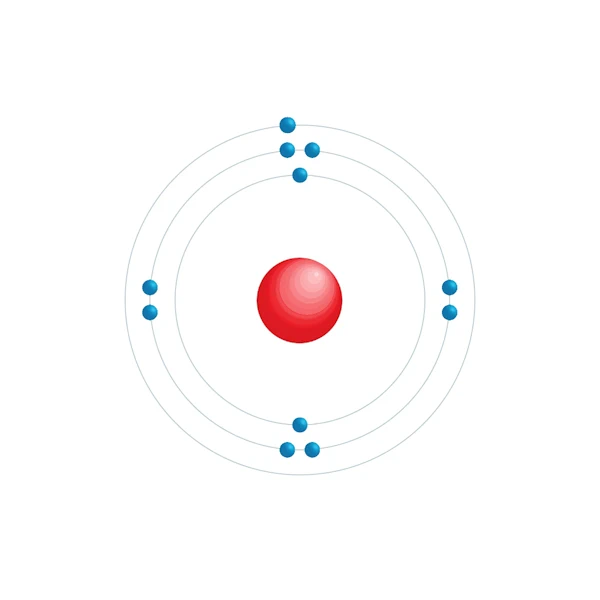
Elektronisch configuratiediagram
| Namn | natrium |
| Aantal | 11 |
| Atomair | 22.98976928 |
| Symbool | Na |
| Fusie | 97.8 |
| Koken | 892 |
| Dichtheid | 0.971 |
| Periode | 3 |
| Groep | 1 |
| Ontdekking | 1807 Davy |
| Overvloed | 23600 |
| Straal | 2.2 |
| Elektronegativiteit | 0.93 |
| Ionisatie | 5.1391 |
| Aantal isotopen | 7 |
| Elektronische configuratie | [Ne] 3s1 |
| Oxidatie stelt | -1,1 |
| Elektron op energieniveau | 2,8,1 |
| Mineralen | Hardheid | Dichtheid |
| Abenakiite-(Ce) | 4.00 / 4.00 | 3.21 |
| Acmonidesite | ||
| Actinolite | 5.50 / 5.50 | 2.98 |
| Adamsite-(Y) | 3.00 / 3.00 | |
| Adranosite | ||
| Adranosite-(Fe) | 2.20 | |
| Aegirine | 6.00 / 6.50 | 3.50 |
| Aegirine-augite | 6.00 / 6.00 | 3.40 |
| Aenigmatite | 5.00 / 6.00 | 3.74 |
| Aerinite | 3.00 / 3.00 | 2.48 |
| Afghanite | 5.50 / 6.00 | 2.55 |
| Agrellite | 5.50 / 5.50 | 2.88 |
| Aiolosite | 3.59 | |
| Ajoite | 2.96 | |
| Albite | 7.00 / 7.00 | 2.61 |
| Alexkhomyakovite | ||
| Alflarsenite | 4.00 / 4.00 | 2.61 |
| Aliettite | 1.00 / 2.00 | |
| Alloriite | 5.00 / 5.00 | 2.35 |
| Alluaivite | 5.00 / 6.00 | 2.76 |
| Alluaudite | 5.00 / 5.50 | 3.45 |
| Almarudite | 6.00 / 6.00 | 2.71 |
| Alnaperbøeite-(Ce) | ||
| Alsakharovite-Zn | 5.00 / 5.00 | 2.90 |
| Altisite | 6.00 / 6.00 | 2.64 |
| Alum-(Na) | 3.00 / 3.00 | 1.67 |
| Alumino-ferrobarroisite | ||
| Alumino-ferrowinchite | ||
| Alumino-magnesiotaramite | ||
| Alumino-ottoliniite | ||
| Aluminobarroisite | 5.00 / 6.00 | 2.94 |
| Aluminokatophorite | 5.00 / 6.00 | |
| Aluminowinchite | ||
| Alumoåkermanite | 4.00 / 5.00 | 3.00 |
| Amarillite | 2.50 / 3.00 | 2.19 |
| Amblygonite | 5.50 / 6.00 | 2.98 |
| Ameghinite | 2.00 / 3.00 | 2.02 |
| Amicite | 5.00 / 5.50 | 2.06 |
| Analcime | 5.00 / 5.00 | 2.30 |
| Andersonite | 2.50 / 2.50 | 2.79 |
| Andesine | 7.00 / 7.00 | 2.66 |
| Andrianovite | 5.00 / 5.00 | 3.02 |
| Angarfite | 2.50 / 2.50 | 2.77 |
| Anorthite | 6.00 / 6.00 | 2.72 |
| Anorthoclase | 6.00 / 6.00 | 2.57 |
| Antipinite | 2.00 / 2.00 | 2.55 |
| Apexite | 2.00 / 2.00 | 1.74 |
| Aphthitalite | 3.00 / 3.00 | 2.70 |
| Aqualite | 4.00 / 5.00 | 2.66 |
| Arapovite | 5.50 / 6.00 | 3.43 |
| Arctite | 5.00 / 5.00 | 3.11 |
| Ardennite-(V) | 6.00 / 7.00 | 3.55 |
| Arfvedsonite | 5.50 / 6.00 | 3.44 |
| Arisite-(Ce) | ||
| Arisite-(La) | 3.00 / 3.50 | 4.07 |
| Aristarainite | 3.50 / 3.50 | 2.03 |
| Armbrusterite | 3.50 / 3.50 | 2.78 |
| Arnhemite | 2.33 | |
| Arrojadite-(BaFe) | 3.54 | |
| Arrojadite-(BaNa) | ||
| Arrojadite-(KFe) | 5.00 / 5.00 | 3.50 |
| Arrojadite-(KNa) | ||
| Arrojadite-(NaFe) | ||
| Arrojadite-(PbFe) | 4.00 / 5.00 | |
| Arrojadite-(SrFe) | ||
| Arseniopleite | 3.50 / 3.50 | 4.22 |
| Arsmirandite | ||
| Ashcroftine-(Y) | 5.00 / 5.00 | 2.61 |
| Aspidolite | 2.00 / 3.00 | 2.89 |
| Astrophyllite | 3.00 / 3.50 | 3.30 |
| Augite | 5.00 / 6.50 | 3.20 |
| Bakhchisaraitsevite | 2.00 / 2.50 | 2.50 |
| Balliranoite | ||
| Banalsite | 6.00 / 6.00 | 3.07 |
| Bannermanite | 3.50 | |
| Bannisterite | 4.00 / 4.00 | 2.83 |
| Barahonaite-(Al) | ||
| Barahonaite-(Fe) | 3.03 | |
| Barentsite | 3.00 / 3.00 | 2.56 |
| Bario-olgite | 4.00 / 4.50 | 4.00 |
| Barnesite | 3.00 / 3.00 | 3.15 |
| Barrerite | 3.00 / 4.00 | 2.13 |
| Barroisite | 5.00 / 6.00 | 3.00 |
| Barrydawsonite-(Y) | ||
| Barytolamprophyllite | 2.00 / 3.00 | 3.62 |
| Batiferrite | 6.00 / 6.00 | |
| Batisite | 5.90 / 5.90 | 3.43 |
| Bazzite | 6.50 / 6.50 | 2.80 |
| Bederite | 5.00 / 5.00 | 3.48 |
| Beidellite | 1.00 / 2.00 | 2.00 |
| Belakovskiite | ||
| Bellbergite | 5.00 / 5.00 | 2.20 |
| Belovite-(Ce) | 5.00 / 5.00 | 4.19 |
| Belovite-(La) | 5.00 / 5.00 | 4.19 |
| Benyacarite | 2.50 / 3.00 | 2.40 |
| Beryllonite | 5.50 / 6.00 | 2.80 |
| Berzeliite | 4.50 / 5.00 | 4.08 |
| Betalomonosovite | ||
| Betpakdalite-NaCa | 2.89 |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se