Lijst met elementen
»
actinium
»
argon
»
astatine
»
barium
»
bismut
»
bohrium
»
Borium
»
broom
»
cadmium
»
calcium
»
cerium
»
cesium
»
chloor
»
chromium
»
curium
»
dubnium
»
erbium
»
europium
»
fermium
»
fluorine
»
fosfor
»
francium
»
gallium
»
goud
»
hafnium
»
hassium
»
helium
»
holmium
»
ijzer
»
indium
»
iridium
»
jodium
»
kalium
»
kobalt
»
koolstof
»
koperen
»
krypton
»
lantaan
»
lithium
»
Lood
»
lutecium
»
mangaan
»
natrium
»
neon
»
Nihonium
»
nikkel
»
niobium
»
nobelium
»
osmium
»
platina
»
polonium
»
radium
»
radon
»
rhenium
»
rhodium
»
rubidium
»
rutenium
»
samarium
»
scandium
»
selenium
»
silicium
»
stikstof
»
tallium
»
tantalum
»
Tennesse
»
terbium
»
thorium
»
thulium
»
tin
»
titanium
»
uranium
»
vanadium
»
wolfraam
»
xenon
»
yttrium
»
Zilver
»
zink
»
zuurstof
»
zwavel
Ar - argon - GEEN EDELGASMETAAL
Argon is een chemisch element van de familie van edelgassen, symbool Ar en atoomnummer 18. Het wordt geproduceerd door fractionele scheiding van gassen in de lucht, voornamelijk door zuurstof en stikstof. Het is geurloos, kleurloos en inert.
argon is een inert gas in gasvormige toestand, dat moleculen met acht atomen vormt (Argon Atoms – Ar8). De molaire massa is 39,948 g/mol. Zijn kenmerken maken het zeer stabiel in aseptische omgevingen. Het is het op twee na meest voorkomende edelgas in de atmosfeer en vormt 0,94% van de lucht. De kooktemperatuur en dampdruk verzadigen respectievelijk bij -186°C en 0,52 MPa.
argon is een slechte thermische en elektrische geleider en wordt daarom gebruikt voor het solderen en vullen van elektronische producten en voor het vullen van fluorescentielampen. Het wordt ook gebruikt als beschermgas, omdat het niet brandbaar is en niet zal reageren met andere moleculen.
argon wordt in veel toepassingen gebruikt, waaronder metallurgie, voor het vullen van branden, voor het vervaardigen van chemicaliën en isolatie, voor het vullen van fluorescentielampen en voor het inert maken van drukvaten en behuizingen waar hoge temperaturen worden gebruikt. argon wordt ook gebruikt bij gaschromatografische analyse om mengsels te scheiden en de concentratie van individuele gassen te meten. Ten slotte wordt argon gebruikt voor de vervaardiging van medicijnen, bijvoorbeeld de pijnstiller lidocaïne.
argon is een inert gas in gasvormige toestand, dat moleculen met acht atomen vormt (Argon Atoms – Ar8). De molaire massa is 39,948 g/mol. Zijn kenmerken maken het zeer stabiel in aseptische omgevingen. Het is het op twee na meest voorkomende edelgas in de atmosfeer en vormt 0,94% van de lucht. De kooktemperatuur en dampdruk verzadigen respectievelijk bij -186°C en 0,52 MPa.
argon is een slechte thermische en elektrische geleider en wordt daarom gebruikt voor het solderen en vullen van elektronische producten en voor het vullen van fluorescentielampen. Het wordt ook gebruikt als beschermgas, omdat het niet brandbaar is en niet zal reageren met andere moleculen.
argon wordt in veel toepassingen gebruikt, waaronder metallurgie, voor het vullen van branden, voor het vervaardigen van chemicaliën en isolatie, voor het vullen van fluorescentielampen en voor het inert maken van drukvaten en behuizingen waar hoge temperaturen worden gebruikt. argon wordt ook gebruikt bij gaschromatografische analyse om mengsels te scheiden en de concentratie van individuele gassen te meten. Ten slotte wordt argon gebruikt voor de vervaardiging van medicijnen, bijvoorbeeld de pijnstiller lidocaïne.
Synthetisch
Radioactief
Vloeistof
Gasvormig
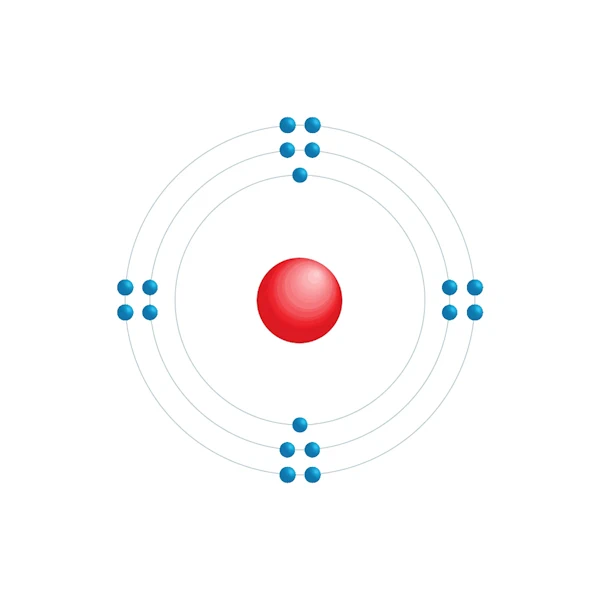
Elektronisch configuratiediagram
| Namn | argon |
| Aantal | 18 |
| Atomair | 39.948 |
| Symbool | Ar |
| Fusie | -189.4 |
| Koken | -185.9 |
| Dichtheid | 0.0017837 |
| Periode | 3 |
| Groep | 18 |
| Ontdekking | 1894 Rayleigh and Ramsay |
| Overvloed | 3.5 |
| Straal | 0.88 |
| Elektronegativiteit | 0 |
| Ionisatie | 15.7596 |
| Aantal isotopen | 8 |
| Elektronische configuratie | [Ne] 3s2 3p6 |
| Oxidatie stelt | 0 |
| Elektron op energieniveau | 2,8,8 |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se