Lijst met elementen
»
actinium
»
argon
»
astatine
»
barium
»
bismut
»
bohrium
»
Borium
»
broom
»
cadmium
»
calcium
»
cerium
»
cesium
»
chloor
»
chromium
»
curium
»
dubnium
»
erbium
»
europium
»
fermium
»
fluorine
»
fosfor
»
francium
»
gallium
»
goud
»
hafnium
»
hassium
»
helium
»
holmium
»
ijzer
»
indium
»
iridium
»
jodium
»
kalium
»
kobalt
»
koolstof
»
koperen
»
krypton
»
lantaan
»
lithium
»
Lood
»
lutecium
»
mangaan
»
natrium
»
neon
»
Nihonium
»
nikkel
»
niobium
»
nobelium
»
osmium
»
platina
»
polonium
»
radium
»
radon
»
rhenium
»
rhodium
»
rubidium
»
rutenium
»
samarium
»
scandium
»
selenium
»
silicium
»
stikstof
»
tallium
»
tantalum
»
Tennesse
»
terbium
»
thorium
»
thulium
»
tin
»
titanium
»
uranium
»
vanadium
»
wolfraam
»
xenon
»
yttrium
»
Zilver
»
zink
»
zuurstof
»
zwavel
mineralogie
elementen
Ru rutenium
Ru - rutenium - METAALACTINIDEN
Ruthenium is een metaalachtig chemisch element met atoomnummer 44 en chemisch symbool Ru. Ruthenium is het 58e meest voorkomende element in de aardkorst, waardoor het een relatief zeldzaam element is. Het is een van de overgangsmetalen en is het nieuwste lid van de platinafamilie.
Ruthenium is bij kamertemperatuur in vaste vorm. Het is hard en broos, grenst aan wit, en vormt zich meestal als een poeder. Het is iets zwaarder dan platina, maar iets lichter dan iridium.
Ruthenium heeft een aantal opmerkelijke eigenschappen. Het is een uitstekende katalysator en de chemische eigenschappen zijn vergelijkbaar met die van andere overgangsmetalen. Het is zeer goed bestand tegen zuren, maar is kwetsbaar voor bleekmiddel en waterstofperoxide. Ruthenium is zeer vuurvast en is bestand tegen extreme temperaturen tot 1700°C.
Ruthenium werd voor het eerst geïsoleerd in 1844 door Karl Klaus, een Russische chemicus. Sindsdien wordt het veel gebruikt voor industriële doeleinden. Dit element wordt veel gebruikt bij de vervaardiging van katalysatoren en verbrandingsmotoren, evenals bij de vervaardiging van metalen draden, staven en andere metalen producten. Het wordt ook gebruikt om legeringen te maken voor het maken van metalen onderdelen die bestand moeten zijn tegen hoge temperaturen.
Ruthenium wordt ook in de geneeskunde gebruikt, vooral voor de vervaardiging van tandprothesen, kronen en bruggen. Het wordt ook gebruikt voor de behandeling van hartaandoeningen en voor de behandeling van bepaalde vormen van kanker.
Ten slotte wordt ruthenium ook gebruikt bij de vervaardiging van sieraden en decoratieve voorwerpen, omdat het zeer moeilijk te corroderen is en bestand is tegen licht, hitte en chemicaliën.
Ruthenium is bij kamertemperatuur in vaste vorm. Het is hard en broos, grenst aan wit, en vormt zich meestal als een poeder. Het is iets zwaarder dan platina, maar iets lichter dan iridium.
Ruthenium heeft een aantal opmerkelijke eigenschappen. Het is een uitstekende katalysator en de chemische eigenschappen zijn vergelijkbaar met die van andere overgangsmetalen. Het is zeer goed bestand tegen zuren, maar is kwetsbaar voor bleekmiddel en waterstofperoxide. Ruthenium is zeer vuurvast en is bestand tegen extreme temperaturen tot 1700°C.
Ruthenium werd voor het eerst geïsoleerd in 1844 door Karl Klaus, een Russische chemicus. Sindsdien wordt het veel gebruikt voor industriële doeleinden. Dit element wordt veel gebruikt bij de vervaardiging van katalysatoren en verbrandingsmotoren, evenals bij de vervaardiging van metalen draden, staven en andere metalen producten. Het wordt ook gebruikt om legeringen te maken voor het maken van metalen onderdelen die bestand moeten zijn tegen hoge temperaturen.
Ruthenium wordt ook in de geneeskunde gebruikt, vooral voor de vervaardiging van tandprothesen, kronen en bruggen. Het wordt ook gebruikt voor de behandeling van hartaandoeningen en voor de behandeling van bepaalde vormen van kanker.
Ten slotte wordt ruthenium ook gebruikt bij de vervaardiging van sieraden en decoratieve voorwerpen, omdat het zeer moeilijk te corroderen is en bestand is tegen licht, hitte en chemicaliën.
Synthetisch
Radioactief
Vloeistof
Gasvormig
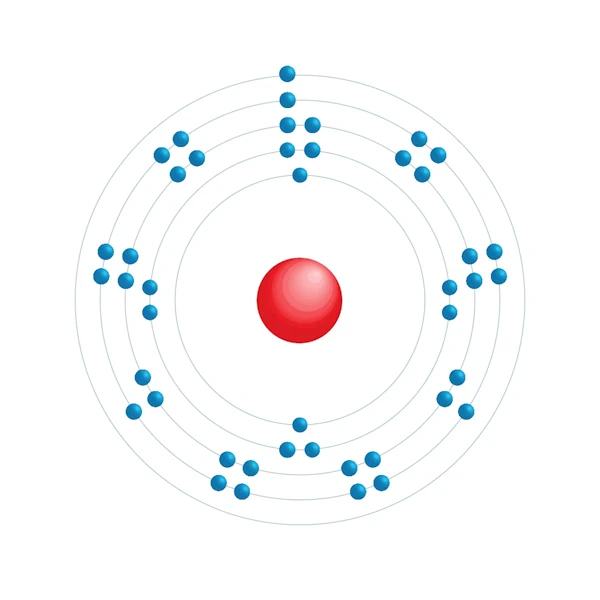
Elektronisch configuratiediagram
| Namn | rutenium |
| Aantal | 44 |
| Atomair | 101.07 |
| Symbool | Ru |
| Fusie | 2310 |
| Koken | 3900 |
| Dichtheid | 12.37 |
| Periode | 5 |
| Groep | 8 |
| Ontdekking | 1844 Klaus |
| Overvloed | 0.001 |
| Straal | 1.9 |
| Elektronegativiteit | 2.2 |
| Ionisatie | 7.3605 |
| Aantal isotopen | 16 |
| Elektronische configuratie | [Kr] 4d7 5s1 |
| Oxidatie stelt | -2,1,2,3,4,5,6,7,8 |
| Elektron op energieniveau | 2,8,18,15,1 |
| Mineralen | Hardheid | Dichtheid |
| Anduoite | 7.00 / 7.00 | 8.00 |
| Hexaferrum | 6.00 / 7.00 | 10.69 |
| Hexamolybdenum | 11.90 | |
| Irarsite | 6.50 / 6.50 | 11.00 |
| Iridarsenite | 5.00 / 5.50 | 10.90 |
| Iridium | 6.00 / 7.00 | 22.60 |
| Laurite | 7.50 / 7.50 | 6.99 |
| Omeiite | 7.00 / 7.00 | 11.20 |
| Osarsite | 6.00 / 6.00 | 8.44 |
| Platarsite | 7.50 / 7.50 | 8.00 |
| Ruarsite | 6.00 / 7.00 | 7.00 |
| Ruthenarsenite | 6.00 / 6.50 | 10.00 |
| Rutheniridosmine | 6.00 / 7.00 | 21.00 |
| Ruthenium | 6.50 / 6.50 | 12.20 |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se