Lijst met elementen
»
actinium
»
argon
»
astatine
»
barium
»
bismut
»
bohrium
»
Borium
»
broom
»
cadmium
»
calcium
»
cerium
»
cesium
»
chloor
»
chromium
»
curium
»
dubnium
»
erbium
»
europium
»
fermium
»
fluorine
»
fosfor
»
francium
»
gallium
»
goud
»
hafnium
»
hassium
»
helium
»
holmium
»
ijzer
»
indium
»
iridium
»
jodium
»
kalium
»
kobalt
»
koolstof
»
koperen
»
krypton
»
lantaan
»
lithium
»
Lood
»
lutecium
»
mangaan
»
natrium
»
neon
»
Nihonium
»
nikkel
»
niobium
»
nobelium
»
osmium
»
platina
»
polonium
»
radium
»
radon
»
rhenium
»
rhodium
»
rubidium
»
rutenium
»
samarium
»
scandium
»
selenium
»
silicium
»
stikstof
»
tallium
»
tantalum
»
Tennesse
»
terbium
»
thorium
»
thulium
»
tin
»
titanium
»
uranium
»
vanadium
»
wolfraam
»
xenon
»
yttrium
»
Zilver
»
zink
»
zuurstof
»
zwavel
mineralogie
elementen
Rb rubidium
Rb - rubidium - ALKALIMETAAL
Rubidium is een metaalachtig chemisch element dat voorkomt in groep 1 (alkalisch) van het periodiek systeem. Het chemische symbool is Rb en het atoomnummer is 37. De naam komt van het Latijnse woord "rubidius" wat "rood" betekent, vanwege de felrode kleur die rubidiumdamp produceert bij blootstelling aan lucht.
rubidium is het meest reactieve chemische element van de basen en heeft een externe elektronische configuratie die vergelijkbaar is met die van kalium en natrium. Het is ook de meest voorkomende van de alkaliën.
Rubidium-metaal is zeer kneedbaar en ductiel en vluchtiger dan kalium en natrium. Het is oplosbaar in water en verandert in Rb+ ionen. Dit ion is sterk oxiderend en reageert makkelijk met zuurstof en vocht in de lucht.
rubidium wordt in verschillende industrieën gebruikt, waaronder de elektronica-industrie en in atoomklokbesturingssystemen. Het wordt ook gebruikt als katalysator in de polymeerindustrie en in de auto-industrie. Het wordt gebruikt als spectrofotometer bij chemische analyse en kan worden gebruikt om rubidium-87 te produceren, een radioactieve isotoop die wordt gebruikt in de geneeskunde en onderzoek.
rubidium is ook een belangrijke voedingsstof. Het is aanwezig in voedsel en is essentieel voor de goede werking van het hart en het zenuwstelsel. rubidium is een essentieel element voor een goede gezondheid van het lichaam.
rubidium is het meest reactieve chemische element van de basen en heeft een externe elektronische configuratie die vergelijkbaar is met die van kalium en natrium. Het is ook de meest voorkomende van de alkaliën.
Rubidium-metaal is zeer kneedbaar en ductiel en vluchtiger dan kalium en natrium. Het is oplosbaar in water en verandert in Rb+ ionen. Dit ion is sterk oxiderend en reageert makkelijk met zuurstof en vocht in de lucht.
rubidium wordt in verschillende industrieën gebruikt, waaronder de elektronica-industrie en in atoomklokbesturingssystemen. Het wordt ook gebruikt als katalysator in de polymeerindustrie en in de auto-industrie. Het wordt gebruikt als spectrofotometer bij chemische analyse en kan worden gebruikt om rubidium-87 te produceren, een radioactieve isotoop die wordt gebruikt in de geneeskunde en onderzoek.
rubidium is ook een belangrijke voedingsstof. Het is aanwezig in voedsel en is essentieel voor de goede werking van het hart en het zenuwstelsel. rubidium is een essentieel element voor een goede gezondheid van het lichaam.
Synthetisch
Radioactief
Vloeistof
Gasvormig
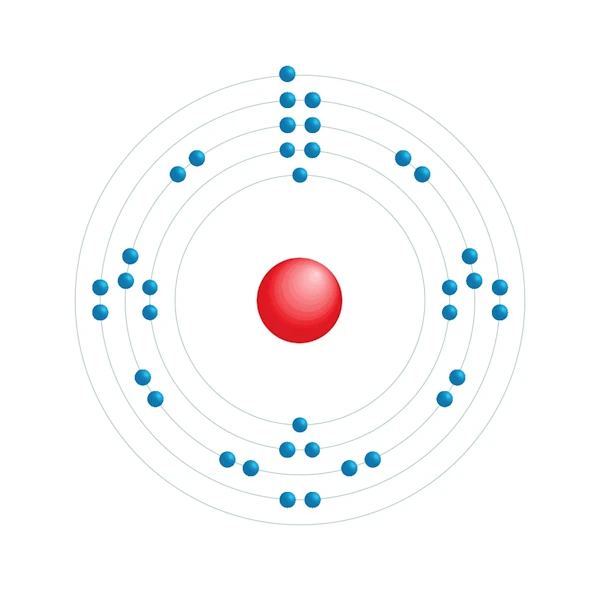
Elektronisch configuratiediagram
| Namn | rubidium |
| Aantal | 37 |
| Atomair | 85.4678 |
| Symbool | Rb |
| Fusie | 39 |
| Koken | 688 |
| Dichtheid | 1.532 |
| Periode | 5 |
| Groep | 1 |
| Ontdekking | 1861 Bunsen and Kirchoff |
| Overvloed | 90 |
| Straal | 3 |
| Elektronegativiteit | 0.82 |
| Ionisatie | 4.1771 |
| Aantal isotopen | 20 |
| Elektronische configuratie | [Kr] 5s1 |
| Oxidatie stelt | 1 |
| Elektron op energieniveau | 2,8,18,8,1 |
| Mineralen | Hardheid | Dichtheid |
| Eveslogite | 5.00 / 5.00 | 2.85 |
| Faizievite | 4.00 / 4.50 | 2.82 |
| Londonite | 8.00 / 8.00 | 3.34 |
| Pautovite | 2.50 / 2.50 | 3.85 |
| Pezzottaite | 8.00 / 8.00 | 2.97 |
| Pollucite | 6.50 / 6.50 | 2.90 |
| Poppiite | 3.36 | |
| Ramanite-(Rb) | ||
| Rubicline | ||
| Telyushenkoite | 6.00 / 6.00 | 2.73 |
| Voloshinite |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se