Lijst met elementen
»
actinium
»
argon
»
astatine
»
barium
»
bismut
»
bohrium
»
Borium
»
broom
»
cadmium
»
calcium
»
cerium
»
cesium
»
chloor
»
chromium
»
curium
»
dubnium
»
erbium
»
europium
»
fermium
»
fluorine
»
fosfor
»
francium
»
gallium
»
goud
»
hafnium
»
hassium
»
helium
»
holmium
»
ijzer
»
indium
»
iridium
»
jodium
»
kalium
»
kobalt
»
koolstof
»
koperen
»
krypton
»
lantaan
»
lithium
»
Lood
»
lutecium
»
mangaan
»
natrium
»
neon
»
Nihonium
»
nikkel
»
niobium
»
nobelium
»
osmium
»
platina
»
polonium
»
radium
»
radon
»
rhenium
»
rhodium
»
rubidium
»
rutenium
»
samarium
»
scandium
»
selenium
»
silicium
»
stikstof
»
tallium
»
tantalum
»
Tennesse
»
terbium
»
thorium
»
thulium
»
tin
»
titanium
»
uranium
»
vanadium
»
wolfraam
»
xenon
»
yttrium
»
Zilver
»
zink
»
zuurstof
»
zwavel
mineralogie
elementen
Kr krypton
Kr - krypton - GEEN EDELGASMETAAL
Krypton (Kr) is een inert metaalachtig wit chemisch element van groep 18, of de zogenaamde edelgasgroep. Dit element is het lichtste van de groep, met een kryptonatoom van 84, iets groter dan een argonatoom (73).
krypton is een zeer zeldzaam gas, aangezien het slechts voor 0,00011% aanwezig is in de atmosfeer van de aarde. Het is iets dichter dan lucht, heeft een zeer lage dampspanning en is praktisch kleurloos. Het kan in het laboratorium worden geproduceerd uit vloeibare lucht en is oplosbaar in water.
krypton is inert en wordt beschouwd als een "edel" gas, omdat het weinig reactief is en niet reageert met andere elementen. De smelttemperatuur is -157°C en de kooktemperatuur is -152°C. Het tripelpunt is -152,2°C, -107,7°C en 5,1°C.
krypton wordt gebruikt in fluorescentielampen om de helderheid en duurzaamheid te verbeteren. Het wordt ook gebruikt in lasers, medische beeldvormingsapparatuur en computers. Het wordt ook gebruikt om sommige scheermesjes te infuseren, om de snijefficiëntie te verbeteren. krypton wordt ook gebruikt bij de vervaardiging van medicijnen en is een belangrijke bron van isotopen voor de diagnose en behandeling van kanker.
krypton is een zeer zeldzaam gas, aangezien het slechts voor 0,00011% aanwezig is in de atmosfeer van de aarde. Het is iets dichter dan lucht, heeft een zeer lage dampspanning en is praktisch kleurloos. Het kan in het laboratorium worden geproduceerd uit vloeibare lucht en is oplosbaar in water.
krypton is inert en wordt beschouwd als een "edel" gas, omdat het weinig reactief is en niet reageert met andere elementen. De smelttemperatuur is -157°C en de kooktemperatuur is -152°C. Het tripelpunt is -152,2°C, -107,7°C en 5,1°C.
krypton wordt gebruikt in fluorescentielampen om de helderheid en duurzaamheid te verbeteren. Het wordt ook gebruikt in lasers, medische beeldvormingsapparatuur en computers. Het wordt ook gebruikt om sommige scheermesjes te infuseren, om de snijefficiëntie te verbeteren. krypton wordt ook gebruikt bij de vervaardiging van medicijnen en is een belangrijke bron van isotopen voor de diagnose en behandeling van kanker.
Synthetisch
Radioactief
Vloeistof
Gasvormig
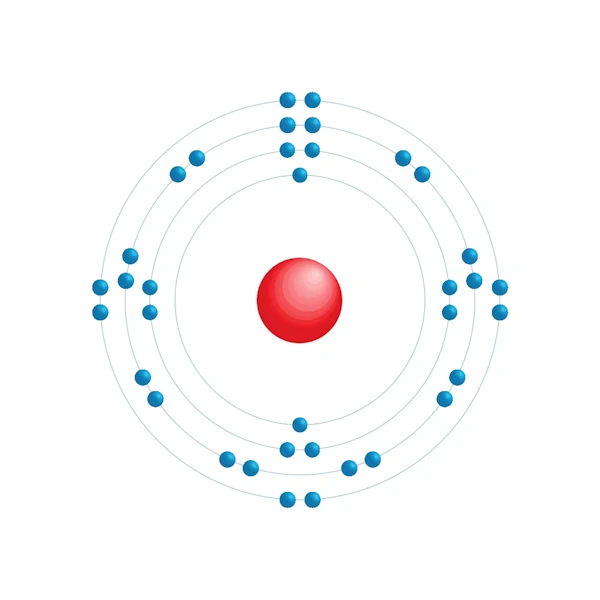
Elektronisch configuratiediagram
| Namn | krypton |
| Aantal | 36 |
| Atomair | 83.798 |
| Symbool | Kr |
| Fusie | -156.6 |
| Koken | -152.3 |
| Dichtheid | 0.003733 |
| Periode | 4 |
| Groep | 18 |
| Ontdekking | 1898 Ramsay and Travers |
| Overvloed | 0.001 |
| Straal | 1 |
| Elektronegativiteit | 0 |
| Ionisatie | 13.9996 |
| Aantal isotopen | 23 |
| Elektronische configuratie | [Ar] 3d10 4s2 4p6 |
| Oxidatie stelt | 2 |
| Elektron op energieniveau | 2,8,18,8 |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se