Lijst met elementen
»
actinium
»
argon
»
astatine
»
barium
»
bismut
»
bohrium
»
Borium
»
broom
»
cadmium
»
calcium
»
cerium
»
cesium
»
chloor
»
chromium
»
curium
»
dubnium
»
erbium
»
europium
»
fermium
»
fluorine
»
fosfor
»
francium
»
gallium
»
goud
»
hafnium
»
hassium
»
helium
»
holmium
»
ijzer
»
indium
»
iridium
»
jodium
»
kalium
»
kobalt
»
koolstof
»
koperen
»
krypton
»
lantaan
»
lithium
»
Lood
»
lutecium
»
mangaan
»
natrium
»
neon
»
Nihonium
»
nikkel
»
niobium
»
nobelium
»
osmium
»
platina
»
polonium
»
radium
»
radon
»
rhenium
»
rhodium
»
rubidium
»
rutenium
»
samarium
»
scandium
»
selenium
»
silicium
»
stikstof
»
tallium
»
tantalum
»
Tennesse
»
terbium
»
thorium
»
thulium
»
tin
»
titanium
»
uranium
»
vanadium
»
wolfraam
»
xenon
»
yttrium
»
Zilver
»
zink
»
zuurstof
»
zwavel
In - indium - SLECHT METAAL
Indium is een metaalachtig chemisch element dat behoort tot groep 13 en periode 5 van het periodiek systeem der elementen. Met atoomsymbool In en atoomnummer 49 heeft indium 13 bekende isotopen, met een atoommassa variërend tussen 121 en 133. Het heeft een relatief atoomgewicht van 114,82.
indium heeft een smeltpunt van 156,60°C en een kookpunt van 2072°C. Het heeft een relatieve dichtheid van 7,29 g/cm3 en een oxidatietoestand van +3. De kleur is grijsachtig wit als het puur is, maar het krijgt een roodachtige kleur als het wordt verwarmd.
indium wordt voornamelijk gebruikt om legeringen voor industrieel gebruik te maken. Het kan aan staal worden toegevoegd om het corrosiebestendiger te maken. Het wordt ook gebruikt om legeringen met tin te produceren, wat handig is in elektronica en elektronische apparaten. Daarnaast speelt indium ook een belangrijke rol bij de vervaardiging van elektronische componenten.
Naast deze industriële toepassingen wordt indium ook gebruikt om vuurvaste materialen voor thermische isolatie te produceren. Het wordt ook gebruikt in zonnecellen en sensoren. Ten slotte wordt het gebruikt om antiaanbaklagen voor keukengerei te produceren.
indium heeft een smeltpunt van 156,60°C en een kookpunt van 2072°C. Het heeft een relatieve dichtheid van 7,29 g/cm3 en een oxidatietoestand van +3. De kleur is grijsachtig wit als het puur is, maar het krijgt een roodachtige kleur als het wordt verwarmd.
indium wordt voornamelijk gebruikt om legeringen voor industrieel gebruik te maken. Het kan aan staal worden toegevoegd om het corrosiebestendiger te maken. Het wordt ook gebruikt om legeringen met tin te produceren, wat handig is in elektronica en elektronische apparaten. Daarnaast speelt indium ook een belangrijke rol bij de vervaardiging van elektronische componenten.
Naast deze industriële toepassingen wordt indium ook gebruikt om vuurvaste materialen voor thermische isolatie te produceren. Het wordt ook gebruikt in zonnecellen en sensoren. Ten slotte wordt het gebruikt om antiaanbaklagen voor keukengerei te produceren.
Synthetisch
Radioactief
Vloeistof
Gasvormig
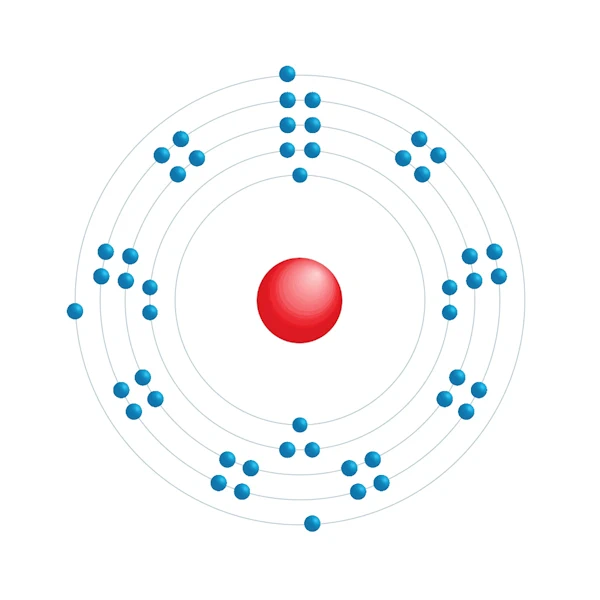
Elektronisch configuratiediagram
| Namn | indium |
| Aantal | 49 |
| Atomair | 114.818 |
| Symbool | In |
| Fusie | 156.2 |
| Koken | 2080 |
| Dichtheid | 7.31 |
| Periode | 5 |
| Groep | 13 |
| Ontdekking | 1863 Reich and Richter |
| Overvloed | 0.25 |
| Straal | 2 |
| Elektronegativiteit | 1.78 |
| Ionisatie | 5.7864 |
| Aantal isotopen | 34 |
| Elektronische configuratie | [Kr] 4d10 5s2 5p1 |
| Oxidatie stelt | 1,2,3 |
| Elektron op energieniveau | 2,8,18,18,3 |
| Mineralen | Hardheid | Dichtheid |
| Abramovite | ||
| Cadmoindite | ||
| Damiaoite | 5.00 / 5.00 | 10.95 |
| Dzhalindite | 4.00 / 4.50 | 4.34 |
| Indite | 5.00 / 5.00 | 4.67 |
| Indium | 3.50 / 3.50 | 7.20 |
| Ishiharaite | ||
| Kudriavite | 6.58 | |
| Laforêtite | 3.00 / 3.00 | 4.93 |
| Petrukite | 4.50 / 4.50 | 4.61 |
| Roquesite | 3.50 / 4.00 | 4.00 |
| Sakuraiite | 4.00 / 4.00 | 4.00 |
| Yanomamite | 5.50 / 6.00 | 3.87 |
| Yixunite | 6.00 / 6.00 | 18.21 |
| Znamenskyite |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se